
 |
|
Главная Введение в электрику [0] [1] [2] [3] [ 4 ] [5] [6] [7] [8] [9] [10] [11] [12] [13] [14] [15] [16] [17] [18] [19] [20] [21] [22] [23] [24] [25] [26] [27] [28] [29] [30] [31] [32] [33] [34] [35] [36] [37] [38] [39] [40] [41] [42] [43] [44] [45] [46] [47] [48] [49] [50] [51] [52] [53] [54] [55] [56] [57] [58] [59] [60] [61] [62] [63] [64] [65] [66] [67] [68] [69] [70] [71] [72] [73] [74] [75] [76] [77] [78] [79] [80] [81] [82] [83] [84] [85] [86] [87] [88] [89] [90] [91] [92] [93] [94] [95] [96] [97] [98] [99] [100] [101] [102] [103] [104] [105] [106] [107] [108] [109] [110] [111] [112] [113] [114] [115] [116] [117] [118] [119] [120] [121] [122] [123] [124] [125] [126] [127] [128] [129] [130] [131] [132] [133] [134] [135] [136] [137] [138] [139] [140] [141] [142] [143] [144] [145] [146] [147] [148] [149] [150] [151] [152] [153] [154] [155] [156] [157] [158] [159] [160] [161] [162] [163] [164] [165] [166] [167] [168] [169] [170] [171] [172] [173] [174] [175] [176] [177] [178] [179] [180] [181] [182] [183] [184] [185] [186] [187] [188] [189] [190] [191] [192] [193] [194] [195] [196] [197] [198] [199] [200] [201] [202] [203] [204] [205] [206] [207] [208] [209] [210] [211] элементов. Примерами элементов являются золото, серебро, медь и кислород. Химическая комбинация двух или более элементов называется соединением (рис. 1-1). Соединение может быть разделено химическим, но не механическим способом. Примерами соединений являются вода, которая состоит из кислорода и водорода, и поваренная соль, состоящая из натрия и хлора. Наименьшая частица соединения, которая еще сохраняет его свойства, называется молекулой. Молекула - это химическая комбинация двух или более атомов. Атом - это наименьшая частица элемента, сохраняющая характеристики элемента. Комбинация элементов и соединений, не вступивших в химическую реакцию, называется смесью. Примерами смесей являются воздух, состоящий из кислорода, азота, углекислого газа и других газов, и соленая вода, которая состоит из соли и воды. 1-1. Вопросы 1. В каких состояниях бывает материя? 2. Как называется субстанция, которая не может быть разделена на более простые сзстанции химическим путем? 3. Что является наименьшей частицей соединения, которая сохраняет его характеристики? 4. Что является наименьшей частицей, которая сохраняет характеристики элемента? 1-2. ЗНАКОМСТВО С АТОМАМИ Атом является наименьшей частицей элемента, сохраняющей его характеристики. Атомы различных элементов отличаются друг от друга. Поскольку существует свыше 100 различных элементов, то существует и свыше 100 различных видов атомов. Каждый атом имеет ядро. Ядро расположено в центре атома. Оно содержит положительно заряженные частицы - протоны и незаряженные частицы - нейтроны. Отри- цательно заряженные частицы вокруг ядер (рис. 1-2). орбита 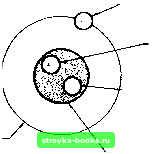 электроны вращаются электрон протон - нейтрон ядро Рис. 1-2. Части атома. обозначения оболочек -о - Количество протонов в ядре атома называется атомным номером элемента. Атомные номера позволяют отличить один элемент от другого. Каждый элемент имеет атомный вес. Атомный вес - это масса атома, которая определяется общим числом протонов и нейтронов в ядре. Электроны практически не дают вклада в общую массу атома, масса электрона составляет только 1/1845 часть массы протона и ею можно пренебречь. Электроны вращаются по концентрическим орбитам вокруг ядра. Каждая орбита называется оболочкой. Эти оболочки заполняются в следующей последовательности: сначала заполняется оболочка К, затем L, М, N и т.д. (рис. 1-3). Максимальное количество электронов, которое может разместиться на каждой оболочке показано на рис. 1-4. оболочки 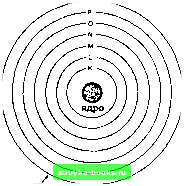 Рис. 1-3. Электроны расположены на оболочках вокруг ядра. ti Раздеп 1
Рис. 1-4. Количество электронов, которое может принять каждая оболочка.
Рис. 1-5. Проводимость различных металлов, используемых в качестве проводников. Внешняя оболочка называется валентной, и количество электронов, содержащееся в ней, называется валентностью. Чем дальше от ядра валентная оболочка, тем меньшее притяжение со стороны ядра испытывает каждый валентный электрон. Таким образом, потенциальная возможность атома присоединять или терять электроны увеличивается, если валентная оболочка не заполнена и расположена достаточно далеко от ядра. Электроны валентной оболочки могут получать энергию. Если эти электроны получат достаточно энергии от внешних сил, они могут покинуть атом и стать свободными электронами, произвольно перемещающимися от атома к атому. Материалы, содержащие большое количество свободных электронов называются проводниками. На рис. 1-5 сравниваются проводимости различных металлов, используемых в качестве проводников. В таблице серебро, медь и золото имеют валентность равную единице (рис. 1-6). Однако серебро является лучшим проводником, поскольку его валентные электроны слабее связаны. Изоляторы, в противоположность проводникам, препятствуют протеканию электричества. Изоляторы стабильны [0] [1] [2] [3] [ 4 ] [5] [6] [7] [8] [9] [10] [11] [12] [13] [14] [15] [16] [17] [18] [19] [20] [21] [22] [23] [24] [25] [26] [27] [28] [29] [30] [31] [32] [33] [34] [35] [36] [37] [38] [39] [40] [41] [42] [43] [44] [45] [46] [47] [48] [49] [50] [51] [52] [53] [54] [55] [56] [57] [58] [59] [60] [61] [62] [63] [64] [65] [66] [67] [68] [69] [70] [71] [72] [73] [74] [75] [76] [77] [78] [79] [80] [81] [82] [83] [84] [85] [86] [87] [88] [89] [90] [91] [92] [93] [94] [95] [96] [97] [98] [99] [100] [101] [102] [103] [104] [105] [106] [107] [108] [109] [110] [111] [112] [113] [114] [115] [116] [117] [118] [119] [120] [121] [122] [123] [124] [125] [126] [127] [128] [129] [130] [131] [132] [133] [134] [135] [136] [137] [138] [139] [140] [141] [142] [143] [144] [145] [146] [147] [148] [149] [150] [151] [152] [153] [154] [155] [156] [157] [158] [159] [160] [161] [162] [163] [164] [165] [166] [167] [168] [169] [170] [171] [172] [173] [174] [175] [176] [177] [178] [179] [180] [181] [182] [183] [184] [185] [186] [187] [188] [189] [190] [191] [192] [193] [194] [195] [196] [197] [198] [199] [200] [201] [202] [203] [204] [205] [206] [207] [208] [209] [210] [211] 0.0015 |
||||||||||||||||||||||||||||||||||||||||||